马来酸匹杉琼注射粉剂(powder solution infusion)
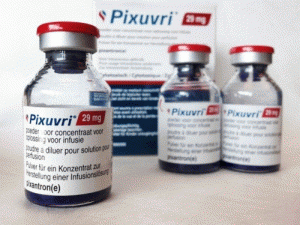 产地国家:法国
产地国家:法国
处方药:是
所属类别: 29毫克/毫升/瓶
包装规格: 29毫克/毫升/瓶
计价单位:瓶
生产厂家英文名:Cell Therapeutics
原产地英文商品名:powder solution infusion 29MG/ML/bottle
原产地英文药品名:pixantrone dimaleate
中文参考商品译名:Pixuvri注射粉剂 29毫克/毫升/瓶
中文参考药品译名:马来酸匹杉琼
简介
部份中文马来酸匹杉琼处方资料(仅供参考)
药品名称:马来酸匹杉琼
类别化学药品:原料+制剂(3.1+3.1类)
剂型及规格:粉针:29mg
适应症
治疗多次复发或难治性的侵袭性B细胞非霍奇金淋巴瘤。
简介
匹杉琼是一种细胞毒性氮杂蒽二酮。和已经批准的蒽环类抗生素(多柔比星及其他)以及蒽二酮(米托蒽醌)不同,匹杉琼是一种弱拓扑异构酶II抑制剂。不同于蒽环类抗生素和蒽二酮,匹杉琼直接烷基化形成稳定的DNA加合物以及交叉链断裂。另外,由于结合了单杂原子进入环结构以及不具有酮基,匹杉琼不可能生成活性氧化产物,结合离子以及形成可能引起蒽环类抗生素的心脏毒性的醇类代谢产物。由于这种独特的结构,与多柔比星和米托蒽醌相比,匹杉琼在动物模型上产生了最低程度的心脏毒性。
注射用匹杉琼于2012年5月10日获准作为单一疗法用于治疗多次复发或难治性的侵袭性B细胞非霍奇金淋巴瘤,商品名为Pixuvri,是欧盟首个被批准用于该病人群体的药物。Pixuvri的上市申请主要基于一项临床III期临床研究PIX 301,研究结果显示患者对Pixuvri联合利妥昔单抗(rituximab)方案的完全应答率较标准方案吉西他滨联合利妥昔单抗更高(分别为20%和6%)。同时,治疗组的无疾病进展期也较对照组长(分别平均为10.2个月和7.6个月)。pixantrone(Pixuvri)扩大适应症用于淋巴瘤pixantrone(Pixuvri)将为医师增加一个重要的治疗选择,也将为患者产生有意义的影响。Pixuri被批准用于治疗多次复发或难治性侵袭性非霍奇金B细胞淋巴瘤患者的治疗。pixantrone(Pixuvri)是蒽环类化疗药物家族中的一员。Pixuri目前用于复发性、侵袭性非何杰金淋巴瘤(NHL)的治疗。
I/II期临床研究显示,pixantrone(Pixuvri)单一用药的疾病完全缓解率达到20%,当pixantrone(Pixuvri)替换了标准治疗药物CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)中的多柔比星时,疾病的完全缓解率达到59%.III期临床也获得了肯定结果。对于本品的潜在治疗领域包括各种何杰金恶性瘤、实体瘤和免疫疾病,研究者期望pixantrone(Pixuvri)能提高蒽环类药物的安全性和有效性。标准治疗药物蒽环霉素已显示出治疗癌症的强有效性,但蒽环霉素总是与累积心脏损伤相关,这大大缩减了蒽环霉素的使用范围。pixantrone(Pixuvri)较蒽环霉素更易于服药。而且,迄今为止还未发现pixantrone(Pixuvri)有严重的心脏不良反应。pixantrone(Pixuvri)将朝着减少心脏毒性、增加治疗有效性和方便患者用药的方向发展。
英文版说明书
PIXUVRI 29 mg poudre pour solution à diluer pour perfusion boîte de 1 flacon de 29 mgIndicationPixuvri est indiqué en monothérapie chez les adultes atteints d'un lymphome non hodgkinien (LNH) agressif à cellules B, à rechutes multiples ou réfractaires. Le bénéfice du traitement par la pixantrone, utilisée en chimiothérapie de cinquième ligne ou supérieure, n'a pas été établi chez les patients réfractaires au dernier traitement.Posologie PIXUVRI 29 mg poudre pour solution à diluer pour perfusion boîte de 1 flacon de 29 mgPixuvri est indiqué en monothérapie chez les adultes atteints d'un lymphome non hodgkinien (LNH) agressif à cellules B, à rechutes multiples ou réfractaires. Le bénéfice du traitement par la pixantrone, utilisée en chimiothérapie de cinquième ligne ou supérieure, n'a pas été établi chez les patients réfractaires au dernier traitement.Contre indications- Hypersensibilité au dimaléate de pixantrone ou à l'un des excipients mentionnés à la rubrique Composition- Immunisation par des vaccins à virus vivants- Myélosuppression profonde- Dysfonctionnement hépatique sévèreEffets indésirables PixuvriRésumé du profil de sécuritéLa sécurité de Pixuvri a été évaluée chez 407 patients.La toxicité la plus fréquente est la myélosuppression et plus particulièrement la suppression de la lignée des neutrophiles. Bien que l'incidence d'une myélosuppression sévère avec conséquences cliniques soit relativement faible, les patients traités par Pixuvri ont été étroitement surveillés par de fréquentes numérations sanguines, pour détecter notamment une éventuelle neutropénie. L'incidence d'infections sévères a été faible et il n'a été observé aucune infection opportuniste associée à l'immunodépression. Même si la survenue d'une toxicité cardiaque se manifestant par une ICC semble être plus faible que celle prévue avec des médicaments apparentés, tels que les anthracyclines, la surveillance de la FEVG par ventriculographie MUGA ou par échocardiographie est recommandée pour évaluer la cardiotoxicité infraclinique. L'expérience avec la pixantrone se limite aux patients présentant une FEVG ≥ 45 %, les valeurs de la plupart des patients étant ≥ 50 %. L'expérience en matière d'administration de Pixuvri à des patients atteints d'une insuffisance cardiaque plus importante est limitée et ne doit être entreprise que dans le cadre d'un essai clinique. D'autres toxicités, telles que des nausées, des vomissements et de la diarrhée, ont été en général peu fréquentes, légères, réversibles, faciles à gérer et attendues chez des patients traités par des agents cytotoxiques. Les effets sur la fonction hépatique ou rénale ont été minimes ou inexistants.Tableau présentant la liste des effets indésirablesLes effets indésirables (EI) décrits avec Pixuvri sont tirés des données finales de l'ensemble des études terminées. Les EI sont présentés dans le Tableau 3 ci-dessous par classe de systèmes d'organes selon la base de données MedDRA et par fréquence: très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000); très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). À l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.Description de quelques réactions indésirablesToxicités hématologiques et complications de la neutropénieLes toxicités hématologiques ont représenté la toxicité la plus fréquemment observée, mais engénéral elles ont pu être gérées facilement à l'aide d'immunostimulants associés si besoin à une transfusion. Alors que dans l'essai randomisé une neutropénie de grade 3 à 4 est survenue plus fréquemment chez les receveurs de Pixuvri, elle est restée non compliquée dans la majorité des cas, non cumulative et associée à une faible incidence de neutropénie fébrile ou d'infections. Fait important, le soutien par les facteurs de croissance n'a pas été systématiquement nécessaire et les transfusions de globules rouges et de plaquettes ont été peu fréquentes (voir rubrique Mises en garde et précautions d'emploi).Toxicité cardiaqueDans l'étude PIX 301, une diminution de la fraction d'éjection a été observée chez 13 patients (19,1 %) dans le groupe Pixuvri. Chez 11 patients recevant Pixuvri, ces événements ont été de grade 1 à 2 et chez 2 patients, ils ont été de grade 3; ces événements ont été passagers et indépendants de la dose de Pixuvri. Des événements d'insuffisance cardiaque (termes «insuffisance cardiaque» et «insuffisance cardiaque congestive» du système de classification MedDRA) sont survenus chez 6 patients (8,8 %) recevant Pixuvri (événements de grade 1 à 2 chez 2 patients, de grade 3 chez 1 patient et de grade 5 chez 3 patients). Trois patients recevant Pixuvri (4,4 %) ont présenté une tachycardie, une arythmie, une tachycardie sinusale ou une bradycardie.Une évaluation des valeurs cardiaques par ventriculographie radio-isotopique ou échographie est recommandée, en particulier chez les patients présentant des facteurs de risque d'augmentation de la toxicité cardiaque. Des mesures répétées de la FEVG par ventriculographie MUGA ou par échographie doivent être envisagées chez les patients présentant des facteurs de risque, tels qu'une forte exposition cumulée aux anthracyclines antérieures ou une maladie cardiaque préexistante importante (voir rubrique Mises en garde et précautions d'emploi).Autres toxicités fréquentesUn changement de couleur de la peau et une chromaturie sont des effets connus liés à l'administration de Pixuvri, en raison de la couleur du composé (bleu). Le changement de couleur de la peau disparaît en général en quelques jours ou semaines, au fur et à mesure de l'élimination du médicament.Déclaration des effets indésirables suspectésLa déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voirPrécautions d'emploiTout traitement initial par Pixuvri doit être précédé d'une évaluation minutieuse des valeurs initiales de la formule sanguine, des taux sériques de la bilirubine totale et de la créatinine totale et de l'évaluation de la fonction cardiaque, telle que mesurée par la fraction d'éjection du ventricule gauche (FEVG).MyélosuppressionUne myélosuppression sévère peut survenir. Les patients traités par Pixuvri sont susceptibles de développer une myélosuppression (neutropénie, leucopénie, anémie, thrombocytopénie et lymphopénie), la manifestation prédominante étant une neutropénie. À la dose et au rythme d'administration recommandés, la neutropénie est généralement passagère, le nadir se situant aux jours 15 à 22 après une administration aux jours 1, 8 et 15 et la guérison intervenant habituellement au jour 28.Une surveillance minutieuse de la formule sanguine est requise, incluant la détermination des nombres de leucocytes, de globules rouges, de plaquettes et du nombre absolu de neutrophiles. Les facteurs de croissance hématopoïétique recombinants peuvent être utilisés conformément aux directives de l'établissement ou aux recommandations de la Société européenne d'oncologie médicale (ESMO, European Society for Medical Oncology). Il convient d'envisager des modifications de la dose (voir rubrique Posologie et mode d'administration).CardiotoxicitéDes modifications de la fonction cardiaque, notamment une diminution de la FEVG ou une insuffisance cardiaque congestive (ICC) fatale peuvent survenir pendant ou après le traitement par Pixuvri.Une maladie cardiovasculaire active ou latente, un traitement antérieur par des anthracyclines ou des anthracènediones, une radiothérapie antérieure ou concomitante appliquée à la région médiastinale ou une utilisation concomitante d'autres médicaments cardiotoxiques peuvent augmenter le risque de toxicité cardiaque. Pixuvri peut provoquer une toxicité cardiaque en présence ou en l'absence de facteurs de risques.Les patients présentant une maladie cardiaque ou des facteurs de risques, tels qu'une valeur de FEVG initiale < 45 %, déterminée par ventriculographie radio-isotopique (MUGA), des anomalies cardiovasculaires cliniquement importantes (de classe 3 ou 4 de la NYHA [New York Heart Association]), un infarctus du myocarde au cours des 6 derniers mois, une arythmie sévère, une hypertension non contrôlée, une angine de poitrine non contrôlée ou une administration antérieure de doses cumulées de doxorubicine ou d'une substance équivalente dépassant 450 mg/m2, doivent faire l'objet d'une évaluation minutieuse du rapport bénéfice/risque avant de recevoir un traitement par Pixuvri.La fonction cardiaque doit être surveillée avant l'instauration du traitement par Pixuvri et périodiquement par la suite. Si une toxicité cardiaque est démontrée en cours de traitement, il convient d'évaluer le rapport bénéfice/risque de la poursuite du traitement par Pixuvri.Cancer secondaireLe développement d'hémopathies malignes, notamment leucémie myéloïde aiguë (LMA) secondaire ou syndrome myélodysplasique (SMD), est un risque connu associé au traitement par les anthracyclines et d'autres inhibiteurs de la topo-isomérase II. La survenue de cancers secondaires, notamment LMA et SMD, peut se produire pendant ou après le traitement par Pixuvri.InfectionDes infections, notamment des pneumonies, cellulites, bronchites et septicémies, ont été signalées au cours des essais cliniques (voir rubrique Effets indésirables). Des infections ont conduit à des hospitalisations, des chocs septiques et des décès. Les patients atteints de neutropénie sont plus sensibles aux infections, bien qu'il n'y ait pas eu d'augmentation de l'incidence des infections atypiques, difficiles à traiter, telles que des infections mycosiques systémiques ou des infections par des organismes opportunistes (comme Pneumocystis jiroveci) au cours des études cliniques.Pixuvri ne doit pas être administré aux patients présentant une infection active grave, ni aux patients ayant des antécédents d'infections chroniques récurrentes ou des maladies sous-jacentes pouvant les prédisposer davantage à une infection grave.Syndrome de lyse tumoraleLa pixantrone peut induire une hyperuricémie résultant du catabolisme intense des purines accompagnant la lyse rapide de cellules néoplasiques (syndrome de lyse tumorale) provoquée par le médicament et entraîner des déséquilibres électrolytiques, susceptibles d'endommager les reins. Les taux sanguins d'acide urique, de potassium, de phosphate de calcium et de créatinine doivent être évalués après le traitement chez les patients présentant un risque élevé de lyse tumorale (taux élevé de LDH, volume tumoral important, taux élevés d'acide urique ou de phosphate sérique avant le début du traitement). Des mesures d'hydratation, d'alcalinisation des urines et de prophylaxie à l'aide d'allopurinol ou d'autres agents de prévention de l'hyperuricémie peuvent minimiser les complications potentielles du syndrome de lyse tumorale.VaccinationLa vaccination peut s'avérer inefficace lorsqu'elle est pratiquée pendant le traitement par Pixuvri. L'immunisation par des vaccins à virus vivants est contre-indiquée, en raison de l'immunosuppression associée au traitement par Pixuvri (voir rubrique Contre-indications).ExtravasationS'il se produit une extravasation, l'administration doit être arrêtée immédiatement et reprise dans une autre veine. Les propriétés non vésicantes de Pixuvri minimisent le risque de réaction locale après une extravasation.Prévention des réactions de photosensibilisationLa photosensibilisation est un risque potentiel fondé sur des données non cliniques in vitro et in vivo et aucun cas confirmé n'a été signalé dans le programme d'essais cliniques. Par mesure de précaution, il convient de conseiller aux patients d'adopter des stratégies de protection contre le rayonnement solaire, notamment le port de vêtements protégeant du soleil et l'utilisation d'un écran solaire. Comme la majorité des réactions de photosensibilisation induites par des médicaments sont dues aux longueurs d'onde de la gamme des UVA, il est recommandé d'utiliser une protection solaire qui absorbe fortement le rayonnement UVA.Patients suivant un régime hyposodéCe médicament contient environ 1000 mg (43 mmol) de sodium par dose après dilution. Les patients qui suivent un régime contrôlé en sodium doivent en tenir compte.Interactions avec d'autres médicamentsAucune interaction entre des médicaments n'a été signalée chez des sujets humains et aucune étude d'interaction n'a été réalisée chez l'homme.Études d'inhibition in vitroDes études in vitro menées avec les isoformes humaines les plus fréquentes du cytochrome P450 (notamment CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 et 3A4) ont montré une possible inhibition de type mixte du CYP1A2 et du CYP2C8 pouvant revêtir une importance clinique. Aucune autre interaction cliniquement importante avec les cytochromes CYPP450 n'a été observée.Théophylline: la coadministration de théophylline, un médicament à index thérapeutique étroit, qui est essentiellement métabolisé par le cytochrome CYP1A2, peut donc, en théorie, induire une augmentation de la concentration entraînant une toxicité de la théophylline. Les taux de cette dernière doivent être soigneusement surveillés dans les semaines qui suivent immédiatement l'instauration du traitement concomitant par Pixuvri.La warfarine est métabolisée en partie par le cytochrome CYP1A2, ce qui suscite en théorie une crainte concernant la coadministration de ce médicament et l'effet que l'inhibition de son métabolisme pourrait avoir sur l'action recherchée. Les paramètres de coagulation, en particulier le rapport international normalisé (INR, International Normalised Ratio), doivent être surveillés durant les jours qui suivent immédiatement l'instauration du traitement concomitant par Pixuvri.L'amitriptyline, l'halopéridol, la clozapine, l'ondansétron et le propranolol sont métabolisés par le cytochrome CYP1A2; la coadministration de Pixuvri peut donc faire craindre, en théorie, une augmentation de la concentration sanguine de ces médicaments.Bien qu'un risque d'inhibition du cytochrome CYP2C8 par la pixantrone n'ait pu être établi, il convient d'être prudent lors de la coadministration de substances métabolisées essentiellement via le cytochrome CYP2C8, comme le répaglinide, la rosiglitazone ou le paclitaxel, par exemple en surveillant soigneusement la survenue d'effets indésirables.Selon des études in vitro, la pixantrone est un substrat des protéines de transport membranaires, P-gp /BRCP et OCT1, et les agents qui inhibent ces transporteurs ont la capacité de diminuer l'efficacité d'absorption et d'excrétion de la pixantrone par le foie. Les numérations sanguines doivent être étroitement surveillées, lors de la coadministration avec des molécules inhibant ces transporteurs comme la cyclosporine A ou le tacrolimus, fréquemment utilisés pour contrôler la maladie chronique du greffon contre l'hôte, et les médicaments anti-VIH comme le ritonavir, le saquinavir ou le nelfinavir.De plus, il convient de prendre des précautions lorsque la pixantrone est coadministrée en continu avec des inducteurs du transport d'efflux, tels que la rifampicine, la carbamazépine et les glucocorticoïdes, car l'excrétion de la pixantrone pourrait être augmentée, d'où une diminution de l'exposition systémique.Grossesse et allaitementFemmes en âge de procréerIl convient de conseiller aux femmes en âge de procréer et à leurs partenaires d'éviter les grossesses.Les femmes et les hommes doivent utiliser une contraception efficace pendant le traitement et jusqu'à 6 mois après l'arrêt du traitement.GrossesseIl n'existe pas de données sur l'utilisation de la pixantrone chez les femmes enceintes. Les études effectuées chez l'animal ont mis en évidence une toxicité pour la reproduction (voir rubrique Données de sécurité précliniques).Pixuvri n'est pas recommandé pendant la grossesse, ni chez les femmes en âge de procréer n'utilisant pas de contraception.AllaitementOn ignore si Pixuvri ou ses métabolites sont excrétés dans le lait maternel.Un risque pour les nouveaux-nés/nourrissons ne peut être exclu.L'allaitement doit être interrompu au cours du traitement avec Pixuvri.FertilitéAprès des administrations répétées de Pixuvri à des doses aussi faibles que 0,1 mg/kg/jour, une atrophie testiculaire dose-dépendante a été détectée chez le chien. Cet effet n'a pas été évalué chez l'homme. Comme avec d'autres agents de la classe générale des agents endommageant l'acide désoxyribonucléique (ADN), Pixuvri peut être associé à une baisse de la fécondité. Alors que cet effet sur la fécondité n'a pas été établi, une mesure de précaution consistera à recommander aux patients masculins d'utiliser des méthodes de contraception (de préférence de type barrière) pendant le traitement et pour une période de 6 mois après le traitement, afin de permettre la maturation de nouveaux spermatozoïdes. Pour prévenir le risque d'infertilité à long terme, il convient d'envisager un dépôt de sperme dans une banque de sperme.Effet sur la conduite de véhiculesOn ignore si Pixuvri a un effet sur l'aptitude à conduire des véhicules et à utiliser des machines.Comment ça marche ?AbsorptionAprès une administration par voie intraveineuse, les concentrations plasmatiques de pixantrone atteignent leurs valeurs maximales à la fin de la perfusion, puis diminuent en suivant une courbe poly-exponentielle. Les propriétés pharmacocinétiques de Pixuvri sont dose-dépendantes entre 3 mg/m2 et 105 mg/m2 et aucune différence substantielle n'a été observée lorsque le médicament a été utilisé en monothérapie ou en association au cours des études. Les expositions moyennes en monothérapie ont été les suivantes:Dose de Pixuvri (mg/m2)D'après une analyse des données pharmacocinétiques de population, pour une dose cible enregistrée de 50 mg/m2 de pixantrone, l'exposition moyenne au cours d'un cycle de 28 jours a été de 6320 ng.h/ml (IC à 90 %: 5990 - 6800 ng.h/ml), pour 3 doses/cycle de 4 semaines.DistributionPixuvri présente un grand volume de distribution de 25,8 l et son taux de liaison aux protéines plasmatiques est d'environ 50 %.BiotransformationDes métabolites acétylés représentent les principaux produits de la biotransformation de la pixantrone. Cependant, in vitro, la conversion de la pixantrone en métabolites acétylés, par la N-acétyltransférase NAT1 ou NAT2, était très limitée. Dans l'urine humaine, le composé était essentiellement excrété sous forme inchangée et de très petites quantités de métabolites acétylés de phase I et de phase II ont été détectées. Le métabolisme ne semble donc pas constituer une voie importante d'élimination de la pixantrone. Les métabolites acétylés ne présentent pas d'activité pharmacologique et sont métaboliquement stables.ÉliminationLa pixantrone présente une clairance plasmatique totale modérée à élevée de 72,7 l/h et une faible excrétion rénale représentant moins de 10 % de la dose administrée en 0 à 24 heures. La demi-vie terminale varie entre 14,5 et 44,8 h, avec une médiane de 23,3 ± 8,0 (n = 14, CV = 34 %) et une médiane de 21,2 h. Du fait de la contribution limitée de la clairance rénale, la clairance plasmatique est essentiellement non rénale. Pixuvri peut être métabolisé dans le foie et/ou excrété dans la bile. Le métabolisme paraissant limité, l'excrétion biliaire de la pixantrone inchangée pourrait être la voie d'élimination principale. La clairance hépatique est à peu près égale au flux plasmatique hépatique, ce qui suggère un taux d'extraction hépatique élevé et, par conséquent, une élimination efficace de la substance active mère. Il est possible que l'absorption hépatique de la pixantrone ait pour médiateurs des transporteurs OCT1 actifs et l'excrétion biliaire les transporteurs P-gp et BCRP.La pixantrone n'a qu'une capacité faible ou nulle d'inhibition du mécanisme de transport par P-gp, BCRP et BSEP in vitro.La pixantrone n'inhibe pas le transport de la metformine ayant pour médiateur OCT1 in vitro, mais elle n'est pas censée inhiber OTC1 in vivo à des concentrations cliniquement pertinentes.La pixantrone est un faible inhibiteur des transporteurs d'absorption OATP1B1 et OATP1B3 in vitro.Linéarité/non-linéaritéLes propriétés pharmacocinétiques de la pixantrone se sont avérées linéaires pour une large gamme de doses, allant de 3 mg/m2 à 105 mg/m2.
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 马来酸匹杉琼注射粉剂(powder solution infusion)