乌拉地尔注射液(Urapidil)- 乌拉地尔注射液-Ebrantil Injektionslösung 50mg/10ml
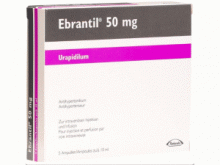 产地国家:瑞士
处 方 药:是
所属类别:50毫克/10毫升 5安瓿/盒
包装规格:50毫克/10毫升 5安瓿/盒
计价单位:盒
生产厂家中文参考译名:
武田制药
生产厂家英文名:
Takeda Pharma AG
原产地英文商品名:
Ebrantil Injektionslösung 50mg/10ml 5Ampullen 10ml
原产地英文药品名:
Urapidil
中文参考商品译名:
Ebrantil注射液 50毫克/10毫升 5安瓿/盒
中文参考药品译名:
乌拉地尔
产地国家:瑞士
处 方 药:是
所属类别:50毫克/10毫升 5安瓿/盒
包装规格:50毫克/10毫升 5安瓿/盒
计价单位:盒
生产厂家中文参考译名:
武田制药
生产厂家英文名:
Takeda Pharma AG
原产地英文商品名:
Ebrantil Injektionslösung 50mg/10ml 5Ampullen 10ml
原产地英文药品名:
Urapidil
中文参考商品译名:
Ebrantil注射液 50毫克/10毫升 5安瓿/盒
中文参考药品译名:
乌拉地尔
简介:
部分中文乌拉地尔处方资料(仅供参考) 英文名:Urapidil 商标名:Ebrantil Injektionslösung 中文名:乌拉地尔注射液 生产商:武田制药 药理作用 本品为一苯哌嗪取代的尿嘧啶衍生物,具有外周和中枢双重作用机制,在外周作用主要为阻断突触后α1受体,使外周阻力下降,扩张血管。中枢作用主要通过激活5-羟色胺-1A受体,降低延髓心血管中枢的交感反馈调节而起降压作用(这不同于可乐宁的中枢作用)。 药代动力学:口服本药30mg的缓释胶囊后,4-6h血药浓度达峰值(166μg/L)。该药在体内迅速代谢为对羟基化合物(M1),芳环邻脱甲基化合物((M2)和脲嘧啶环N-脱甲基化合物((M3),在人体主要生成没有抗高血压作用的M1。人体的50%-70%原药及其代谢物通过肾脏排泄,余下的通过粪便排除。T1/2约为4.7h,绝对生物利用72%,与人体蛋白结合率为80%。 适应证 乌拉地尔缓释胶囊 1.各种类型高血压,特别是需要长期用药者 2.重症高血压、高血压危象、充血性心力衰竭等患者使用乌拉地尔注射剂治疗后病情缓解者 3.良性前列腺肥大 乌拉地尔注射剂 1.重症高血压、高血压危象 2.围手术期高血压 3.充血性心力衰竭:主要用于治疗高血压心脏病、冠状动脉硬化性心脏病、扩张性心肌病、肾性高血压或肾透析时等引起的急性左心衰竭或慢性心衰病情加重者 用法用量 乌拉地尔缓释胶囊 高血压:30-60mg/次,2-3次/日 前列腺肥大:30mg/次,2次/日。 乌拉地尔注射剂 重症高血压或高血压危象: 1.将12.5-25mg乌拉地尔注射剂加入10ml生理盐水或葡萄糖溶液中缓慢静脉注射,观察血压变化,5-10分钟后如必要可重复注射12.5-25mg。 2.为了维持疗效或缓慢降压的需要,可将乌拉地尔注射剂溶解在生理盐水或葡萄糖溶液中静点,滴速一般为100-400μg/min。(注意剂量个体化)。 围手术期高血压: 通常用0.4±0.2mg/kg静脉注射。必要时可重复注射。 充血性心力衰竭:除血压明显增高者先用12.5-25mg乌拉地尔注射剂溶于10ml生理盐水或葡萄糖溶液中缓慢静推外,一般宜直接静脉点滴,滴速为100-400μg/min。根据病情调整用药剂量和滴速。可每日1次或24小时连续应用,疗程一般3-6天,亦可长于6天。观察血压变化,若血压低可配合使用多巴胺。 禁忌证 1.鉴于临床经验不足,目前暂不主张应用于孕妇及哺乳期妇女。 2.凡有血管扩张剂使用禁忌证者亦禁用本药。 3.对本品过敏者。 4.不提倡与血管紧张素转化酶抑制剂合用。 不良反应 偶见有头痛、头晕、恶心、疲劳、心悸、心律失常、瘙痒、失眠等。有的病人用针剂后,在胸骨后有受压感及呼吸困难。有的引起体位性低血压。 超量用药,循环系统和中枢神经系统会引起头晕、直立性综合症、虚脱,疲劳等,应给予一般处理并静脉缓慢注射血管收缩药肾上腺素。 贮存条件 胶囊室温(15-250C)密闭干燥处保存,有效期3年。针剂: 室温避光保存,有效期3年。 英文说明书: Ebrantil Injektionslösung 50mg/10ml 5Ampullen 10ml Fachinformationen Zusammensetzung Wirkstoff: Urapidilum ut Urapidili hydrochloridum Hilfsstoffe: Propylenglycolum, Natrii phosphates, Aqua. Galenische Form und Wirkstoffmenge pro Einheit 1 Ampulle Ebrantil 50 enthält: Wirkstoff: Urapidilum 50 mg ut Urapidili hydrochloridum Hilfsstoffe: Propylenglycolum, Natrii phosphates, Aqua q.s. ad solutionem pro 10 ml. Indikationen/Anwendungsmöglichkeiten Bluthochdruck. Hypertensive Notfälle (z.B. krisenhafter Blutdruckanstieg), schwere bzw. schwerste Formen der Hochdruckkrankheit, therapieresistenter Hochdruck. Die Behandlung des krisenhaften Blutdruckanstiegs bei Vorliegen eines Phäochromozytoms ist möglich. Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen. Blutdrucksenkung bei krisenhaftem Blutdruckanstieg von Normotonikern während und/oder nach Operationen. Dosierung/Anwendung Erwachsene Übliche Dosierung Ebrantil wird intravenös als Injektion oder Infusion am liegenden Patienten verabreicht. Sowohl ein- oder mehrmalige Injektion als auch intravenöse Langzeitinfusion sind möglich. Injektionen lassen sich mit anschliessender Langzeitinfusion kombinieren. Überlappend mit der parenteralen Akuttherapie ist der Übergang auf eine Dauertherapie mit oral zu verabreichenden Blutdrucksenkern möglich. Hypertensive Notfälle, schwere und schwerste Formen der Hypertonie sowie therapieresistente Hypertonie: Als Injektion werden 10-50 mg Ebrantil intravenös injiziert. Innerhalb von 5 Minuten ist eine blutdrucksenkende Wirkung zu erwarten. Abhängig vom Blutdruckverhalten kann die Injektion von Ebrantil wiederholt werden. Für eine intravenöse Dauertropfinfusion verdünnt man 250 mg Ebrantil (5 Ampullen Ebrantil 50) in 500 ml einer kompatiblen Infusionslösung, z.B. physiologische Kochsalzlösung, 5- oder 10%ige Glukoselösung, 5%ige Lävuloselösung oder Dextran-40-Lösung mit 0,9% Natriumchlorid. Die kompatible Höchstmenge beträgt 4 mg Ebrantil pro ml Infusionslösung. Wegen physikalisch-chemischer Inkompatibilitäten sollte Ebantril nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden: aufgrund der sauren Eigenschaften der Injektionslösung kann es zu einer Trübung oder Ausflockung kommen. Bei Verwendung eines Perfusors zur Gabe der Erhaltungsdosis werden 20 ml Ebrantil-Injektionslösung (= 100 mg Ebrantil) in einer Perfusorspritze aufgezogen und bis zu einem Volumen von 50 ml mit einer kompatiblen Infusionslösung (siehe oben) verdünnt. Für die Anfangsdosis kommt eine Infusionsgeschwindigkeit von bis 2 mg/min in Frage. Die Erhaltungsdosis (im Mittel 9 mg/h) und die Dauer der Infusion (nicht länger als 48 Stunden) sind dem Blutdruck anzupassen. Das Ausmass der Blutdrucksenkung wird von der in den ersten 15 Minuten infundierten Dosis bestimmt. Nachfolgend kann der eingestellte Blutdruck mit wesentlich kleineren Dosen aufrechterhalten werden. Kontrollierte Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen: Dosierungsschema: Zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus kommen kontinuierliche Infusion per Perfusor oder Dauertropfinfusion zur Anwendung. Spezielle Dosierungsanweisungen Wird Ebrantil nicht als erstes blutdrucksenkendes Medikament gegeben, so kann es nach intravenöser Verabreichung zu einem ausgeprägten Blutdruckabfall mit Bradykardie und/oder Herzstillstand kommen. Daher ist ausreichend lange auf den Wirkungseintritt des/der zuvor gegebenen blutdrucksenkenden Mittel(s) zu warten. Die Dosierung von Ebrantil ist entsprechend niedriger zu wählen. Ältere Patienten Bei älteren Patienten müssen blutdrucksenkende Mittel mit entsprechender Vorsicht und zu Beginn in kleineren Dosen verabreicht werden, da bei diesen Patienten die Empfindlichkeit gegenüber derartigen Präparaten oftmals verändert ist. Nieren- und Leberfunktionsstörungen Bei Patienten mit leichter bis mittlerer Nieren- und/oder Leberfunktionsstörungen kann eine mässige Dosisverringerung von Ebrantil erforderlich sein. Kinder und Jugendliche Die für dieses Präparat in Frage kommenden Indikationen sind in der Pädiatrie ausserordentlich selten. Die Anwendung und Sicherheit von Ebrantil, Injektionslösung bei Kindern und Jugendlichen ist bisher nicht geprüft worden. Therapiedauer Nicht länger als 48 Stunden. Kontraindikationen Ebrantil Injektionslösung soll nicht angewendet werden bei Aortenisthmusstenose, arteriovenösem Shunt, ausgenommen: hämodynamisch nicht wirksamer Dialyse-Shunt, sowie bei Überempfindlichkeit gegenüber einem der Inhaltsstoffe. Warnhinweise und Vorsichtsmassnahmen Wurden vor Ebrantil bereits andere blutdrucksenkende Substanzen angewendet, so ist besondere Vorsicht hinsichtlich Dosierung und Wartezeit geboten (siehe auch «Dosierung/Anwendung»). Zu rascher Blutdruckabfall kann zu Bradykardie oder Herzstillstand führen. Besondere Vorsicht bei der Anwendung von Ebrantil i.v. 50 mg ist erforderlich bei Herzinsuffizienz, deren Ursache in einer mechanischen Funktionsbehinderung liegt (z.B. Aortenklappen- oder Mitralklappenstenose), bei Lungenembolie oder bei durch Perikarderkrankungen bedingter Einschränkung der Herzaktion; Kindern und Jugendlichen, da keine Untersuchungen hierzu vorliegen; Patienten mit Leberfunktionsstörungen; Patienten mit mässiger bis schwerer Nierenfunktionsstörung; älteren Patienten; Patienten, die gleichzeitig Cimetidin erhalten (vgl. Rubrik «Interaktionen»). Überempfindlichkeit/Urtikaria/Angioödem Bei mit Ebrantil behandelten Patienten sind Urtikaria und Angioödeme des Gesichts, der Lippen, Zunge, Glottis und/oder des Larynx beobachtet worden (siehe auch «Unerwünschte Wirkungen»). Ebrantil sollte in diesen Fällen sofort abgesetzt und der Patient sorgfältig überwacht werden, bis die Schwellung verschwunden ist. Sogar Patienten, bei denen die Schwellungen nur die Zunge involviert, ohne Atemnot, benötigen unter Umständen eine verlängerte Beobachtung, da die Behandlung mit Antihistaminika und Kortikosteroiden ungenügend sein kann. Bei Patienten, bei denen Zunge, Glottis oder Larynx betroffen sind, ist es möglich, dass die Atemwege blockiert werden. Sind Zunge, Larynx und Glottis betroffen, so sollten sofort adäquate therapeutische Massnahmen ergriffen werden, welche die subkutane Injektion einer Lösung von Adrenalin 1:1000 (0,3 ml bis 0,5 ml) und/oder Massnahmen zur Sicherstellung eines offenen Atemwegs einschliessen können. Der Patient sollte medizinisch streng überwacht werden. Interaktionen Urapidil verändert weder die Aktivität noch die individuelle Reaktionsweise des Plasmarenins. Alpha-Rezeptorenblocker, Vasodilatatoren und andere Arzneimittel zur Behandlung der Hochdruckkrankheit (auch Diuretika), Zustände mit Volumenmangel (Durchfall, Erbrechen) oder Alkoholgenuss können die blutdrucksenkende Wirkung von Urapidil verstärken. Bei gleichzeitiger Gabe von Cimetidin ist mit einer Erhöhung der Urapidil-Serumspiegelmaxima zu rechnen. Wechselwirkungen mit gleichzeitig verabreichten Narkose-, Herz- und Beruhigungsmitteln sowie gerinnungshemmenden, harnsäuresenkenden, blutzucker- und blutfettsenkenden Mitteln sind bislang nicht beschrieben. Wegen mangelnder klinischer Erfahrung wird die Kombination mit ACE-Hemmern nicht empfohlen. Schwangerschaft/Stillzeit Schwangerschaft Es gibt nur begrenzte Daten zur Anwendung bei Schwangeren. Urapidil ist bei Tieren nicht teratogen, tierexperimentelle Studien haben jedoch eine Reproduktionstoxizität, bei Dosierungen gezeigt, die als ausreichend über der maximalen menschlichen Dosis liegend angesehen werden (siehe «Präklinische Daten»). Urapidil 50 wird während der Schwangerschaft nicht empfohlen, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus. Urapidil wird nicht bei Frauen im gebärfähigen Alter empfohlen, die keine wirksame Verhütung anwenden. Stillzeit Es ist nicht bekannt, ob Urapidil in die menschliche Muttermilch ausgeschieden wird, daher sollten Mütter während der Behandlung mit Urapidil nicht stillen. Fertilität Es wurden keine klinischen Studien über die Auswirkungen auf die männliche und weibliche Fruchtbarkeit durchgeführt. Tierversuche haben gezeigt, dass Urapidil die Fruchtbarkeit beeinflusst (siehe «Präklinische Daten»), aber die Relevanz für den Menschen ist nicht bekannt. Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Masse bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenhang mit Alkohol. Unerwünschte Wirkungen Im Folgenden sind die unerwünschten Wirkungen aufgelistet, die nach Anwendung von Ebrantil auftreten können. Die Häufigkeiten sind folgendermassen definiert: sehr häufig: >10%; häufig: ≥1% <10%; gelegentlich: ≥0,1% <1%; selten ≥0,01% <0,1%; sehr selten inkl. Einzelfälle: <0,01%. Erkrankungen des Nervensystems Häufig: Schwindel*, Kopfschmerzen*. Sehr selten: Unruhe*. Herzerkrankungen Gelegentlich: Herzklopfen*, Tachykardie*, Bradykardie*, Druckgefühl hinter dem Brustbein*, Atemnot*, unregelmässige Herzschlagfolge*. Sehr selten: kollapsähnliche Zustände (Orthostasen). Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: verstopfte Nase. Erkrankungen des Gastrointestinaltrakts Häufig: Übelkeit Gelegentlich: Erbrechen Erkrankungen der Haut und des Unterhautgewebes Gelegentlich: Schweissausbruch Selten: Allergische Erscheinungen (Juckreiz, Hautrötung, Exantheme). Einzelfälle: Angioödem und Urtikaria. Erkrankungen der Geschlechtsorgane und der Brustdrüse Selten: Priapismus. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Gelegentlich: Müdigkeit Diese unerwünschten Wirkungen sind in der Regel auf eine zu rasche Blutdrucksenkung durch Urapidil zurückzuführen. Erfahrungsgemäss verschwinden diese Nebenwirkungen jedoch innerhalb von Minuten, auch während Langzeitinfusion, so dass eine Unterbrechung der Behandlung nicht erforderlich ist. Eine Natriumretention wurde bislang unter Urapidiltherapie nicht beobachtet. Überdosierung Symptome einer Überdosierung sind seitens des Kreislaufs: Schwindel, Orthostasesyndrom und Kollaps seitens des Zentralnervensystems: Müdigkeit und verminderte Reaktionsfähigkeit. Therapie bei Überdosierung: Eine übermässige Blutdrucksenkung kann durch Hochlagern der Beine und Volumensubstitution gebessert werden. Falls diese Massnahmen nicht ausreichen, können gefässverengende Präparate langsam und unter Blutdruckkontrolle i.v. injiziert werden. In seltenen Fällen ist die Gabe von Adrenalin in der üblichen Verdünnung und Dosis (100-1000 µg) notwendig. Eigenschaften/Wirkungen ATC-Code C02CA06 Wirkungsmechanismus, Pharmakodynamik Der blutdrucksenkende Effekt von Urapidil beruht auf einer gleichzeitigen Beeinflussung zentraler und peripherer Funktionen des sympathischen Nervensystems. Urapidil führt zu einer Senkung des systolischen und diastolischen Blutdrucks durch Verminderung des peripheren Widerstandes. Urapidil hemmt bevorzugt periphere postsynaptische α1-adrenerge Rezeptoren, mindert die Neurotransmission an den peripheren sympathischen Nervenendigungen und bewirkt zentral eine Abnahme des Sympathikotonus. Eine beabsichtigte oder versehentliche Unterbrechung der Ebrantil-Therapie hat keine abrupte Blutdrucksteigerung zur Folge. Belastungsbedingte Blutdruckspitzen bei Hochdruckkranken werden durch Urapidil gedämpft. Die Herzfrequenz bleibt weitgehend konstant. Das Herzzeitvolumen wird nicht verändert; ein infolge erhöhter Nachlast vermindertes Herzzeitvolumen kann ansteigen. Nach Injektion von Urapidil tritt kein initialer Blutdruckanstieg auf. Eine Normalisierung des Lungenkapillardruckes wurde beobachtet. Unter Urapidil bleibt die physiologische Blutdruckregulation erhalten. Daher ist eine Senkung des Blutdrucks in hypotone Bereiche nicht zu befürchten. Urapidil zeichnet sich durch eine grosse therapeutische Breite aus. Seine Wirkung ist gut steuerbar. Nach den bisherigen Erkenntnissen liegen keinerlei Hinweise auf einen Ausschluss von Patienten mit verminderter Herzmuskelleistung und eingeschränkter Atemfunktion vor. Klinische Wirksamkeit Klinische Langzeitstudien haben die Eignung von Urapidil als Monotherapeutikum für die Langzeitbehandlung des Bluthochdrucks erwiesen. Nach intravenöser Applikation erfolgt die Reduktion sowohl systolischer als auch diastolischer Blutdruckwerte schnell, aber nicht drastisch. Nach Absetzen der intravenösen Therapie steigt der Blutdruck langsam innerhalb von 2-3 Std. wieder an. Das ist besonders vorteilhaft in der postoperativen Phase nach intraoperativer Blutdrucksenkung von Hochdruckpatienten. Pharmakokinetik Absorption/Distribution Nach intravenöser Gabe wird eine Eliminationshalbwertszeit für Urapidil aus dem Serum von im Mittel 2,5 Std. gemessen. Das Verteilungsvolumen errechnet sich zu 0,59 l/kg, ein mittlerer Clearance-Wert wird zu 0,17 l/Std./kg bestimmt. Metabolismus Im Urin des Menschen findet man ausser der Muttersubstanz (10-15%) den biologisch inaktiven Hauptmetaboliten M1 (= 6-{3-[4-(2-Methoxy-4-hydroxyphenyl)-piperazin-1-yl]-propyl-amino}-1,3 dimethyluracil) zu ca. 30% der verabreichten Dosis, daneben noch geringe Mengen der Metaboliten M2 und M3. Elimination Die Ausscheidung von Urapidil erfolgt zu etwa 76% über die Niere, zu ca. 20% über den Stuhl. Die Plasmaeiweissbindung von Urapidil (Humanserum) beträgt in vitro 94%. Präklinische Daten Präklinische Daten zeigen keine besondere Gefährdung des Menschen aufgrund der durchgeführten Studien zur Sicherheitspharmakologie. Toxizität bei wiederholter Verabreichung Wiederholte intravenöse Verabreichungen an Tieren zeigten keine Letalität bis zur höchsten getesteten Dosis (bei der Ratte 300 mg/kg über 7 Tage und 40 mg/kg für 4 Wochen; beim Hund 75 mg/kg über 7 Tage und 50 mg/kg über 4 Wochen). Befunde wie Sedierung, verminderte Motorik, Dyspnoe, erhöhte Herzfrequenz, Blutdruckabfall und muskuläre Hypertonie waren bei den Ratten innerhalb weniger Stunden nach der Verabreichung reversibel und bei Hunden innerhalb 24 Stunden. Studien zur chronischen Toxizität in denen bei Ratten Dosen von bis zu 266 mg/kg und bei Hunden Dosen von 64 mg/kg über einen Zeitraum von 12 Monaten oral verabreicht wurden, zeigten Befunde wie Sedierung, Verlängerung des Östrogenzyklus, Hypersalivation und Zittern in hohen Dosen. Mutagenes und tumorerzeugendes Potential Urapidil zeigte in Untersuchungen an Bakterien (AMES-Test, Host Mediated Assay), an Humanlymphozyten und im Knochenmark-Metaphasetest an der Maus keine mutagenen Eigenschaften. Ein Test auf DNS-Reparatur an Rattenhepatozyten verlief ebenfalls negativ. Aus Kanzerogenitätsuntersuchungen an Mäusen und Ratten über 18 und 24 Monate haben sich keine für den Menschen relevanten Hinweise auf ein tumorerzeugendes Potential ergeben. In speziellen Untersuchungen an Ratten und Mäusen zeigte sich, dass Urapidil den Prolaktinspiegel erhöht. Beim Nager führt ein erhöhter Prolaktinspiegel zur Stimulation des Wachstums von Mammagewebe. Aufgrund der Kenntnisse über den Wirkungsmechanismus ist diese Wirkung für den Menschen bei therapeutischer Dosierung nicht zu erwarten und konnte in klinischen Studien nicht nachgewiesen werden. Reproduktionstoxizität Urapidil war bei Mäusen, Ratten und Kaninchen nicht teratogen. Darüber hinaus hatte Urapidil keinen Einfluss auf laktierende Ratten oder auf die Nachkommen während der Laktation und später nach der Entwöhnung, gemessen an Überleben, Verhalten, Aussehen, Körpergewicht und Anzeichen der Reifung. Urapidil hat das Potenzial, die Fruchtbarkeit von Männchen und Weibchen zu verringern und embryonal-fötale Sterblichkeit zu induzieren. Eine Verlängerung des Östruszyklus bei weiblichen Ratten und Mäusen wurde in Reproduktionsstudien und Studien zur chronischen Toxizität beobachtet, aber die Relevanz für den Menschen ist nicht bekannt. Sonstige Hinweise Inkompatibilitäten Ebrantil 50 soll nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden, da es aufgrund der sauren Eigenschaften der Injektionslösung zur Trübung oder Ausflockung kommen kann. Haltbarkeit Das Präparat darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden. Besondere Lagerungshinweise Nicht über 30 °C lagern. Arzneimittel für Kinder unzugänglich aufbewahren. Hinweise für die Handhabung Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 50 Stunden bei 15-25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich. Weitere Informationen: vgl. Rubrik «Dosierung/Anwendung». Zulassungsinhaberin Takeda Pharma AG, 8152 Opfikon.用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 乌拉地尔注射液(Urapidil)- 乌拉地尔注射液-Ebrantil Injektionslösung 50mg/10ml
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 乌拉地尔注射液(Urapidil)- 乌拉地尔注射液-Ebrantil Injektionslösung 50mg/10ml