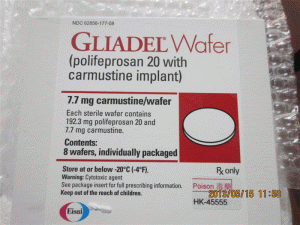
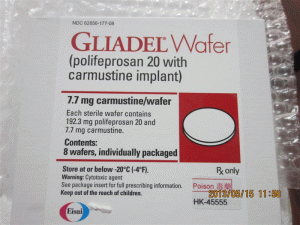
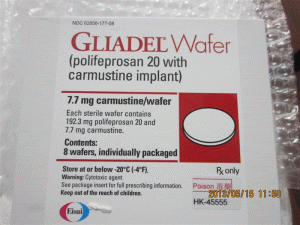
卡莫司汀植入物片Gliadel WAFER 7.7mge(carmustine implant)
 药店国别:
产地国家:美国
处方药:是
所属类别: 7.7毫克/片,8片/盒
包装规格: 7.7毫克/片,8片/盒
计价单位:盒
生产厂家中文参考译名:
生产厂家英文名:Arbor Pharmaceuticals, LLC
原产地英文商品名:GLIADEL WAFER IMPLANT DS 8
原产地英文药品名:CARMUSTINE IN POLIFEPROSAN 20
中文参考商品译名:Gliadel WAFER植入物 7.7毫克/片 8片/包
中文参考药品译名:卡莫司汀
曾用名:
简介:GLIADEL®WAFER(carmustine implant,中文译名卡莫司汀植入膜剂)-全球唯一治疗恶性胶质瘤新药近日,FDA批准其治疗脑癌的专利药:以聚苯丙生20为载体的卡莫司汀植入膜剂(polifeprosan 20with carmustineimplant,Gliadel)为罕用药,在治疗接受一期切除术的恶性胶质瘤患者领域享有7年的市场独占期。Gliadel为一种白色至灰白色的一角硬币大小的薄膜,包含生物可降解聚合物聚苯丙生20和7.7mg卡莫司汀(carmustine,BCNU),卡莫司汀是治疗恶性胶质瘤的常用静脉给药的化疗药物。当手术切除脑瘤时,在经手术创建的空腔中可最多植入8片本品。在植入处,Gliadel将缓慢溶解,直接向肿瘤部位释放高浓度卡莫司汀,使扩撒到其它部位的药物减至最少。Gliadel适应证是新诊断为高度恶性胶质瘤的患者的手术和放疗辅助药物,也可作为多形性胶质母细胞瘤(GBM)复发患者的手术辅助用药。批准日期:2012年12月31日,公司:ArborPharmaceuticals, LLCGLIADEL®WAFER(卡莫司汀[carmustineimplant])植入物,用于颅内使用美国初步批准:1996年
作用机制
GLIADEL晶片的活性是由于释放肿瘤切除腔中的卡莫司汀,DNA和RNA烷基化剂的细胞毒性浓度。在暴露于切除腔的水环境中,共聚物中的酸酐键被水解,将卡莫司汀,羧基苯氧基丙烷和癸二酸释放到周围的脑组织中。适用范围及用途GLIADEL晶片是一种烷基化药物
适应症
用于治疗:新诊断的高级恶性胶质瘤作为手术和放射的辅助手段和复发性胶质母细胞瘤多形性作为手术的辅助手段。
剂量和管理推荐剂量:
8毫克7.7毫克晶片(总剂量61.6毫克)植入颅内。遵循准备和处理建议。剂量形式和强度每个GLIADEL晶片含有7.7毫克卡莫司汀。
禁忌症
没有
警告和注意事项癫痫发作:
监测患者癫痫发作后的植入。颅内高血压:监测患者颅内压升高的迹象。损伤神经外科伤口愈合:监测患者开颅手术并发症。脑膜炎:监测患者细菌或化学性脑膜炎的症状。晶片移植:监测患者阻塞性脑积水的征兆。胚胎- 胎儿毒性:可引起胎儿伤害。
不良反应
新诊断的高级恶性胶质瘤:最常见的不良反应(发生率>10%,手臂差异≥4%)为脑水肿,虚弱,恶心,呕吐,便秘,伤口愈合异常和抑郁。复发性高级恶性胶质瘤:最常见的不良反应(发生率>
10%,手臂差异≥4%)为尿路感染,伤口愈合异常和发烧。
在特定人口中使用儿科用药:
安全无效。
如何提供/存储和处理
GLIADEL晶圆在单个剂量治疗盒中提供,包含八个单独包装的晶片。 每个晶片含有7.7毫克卡莫司汀,并包装在两个铝箔层压袋中。内袋是无菌的,设计用于保持产品不育,并保护产品免受潮湿。 外袋是可剥离的外包装。外袋的外表面不是无菌的。单剂量治疗盒NDC:24338-050-08将GLIADEL晶片存放在-20ºC或以下(-4ºF)。在30天的时间内,不要将未打开的铝箔袋在室温下保持六个小时以上,最多三次。GLIADEL晶片是一种细胞毒性药物,应特别处理和处置程序。
药店国别:
产地国家:美国
处方药:是
所属类别: 7.7毫克/片,8片/盒
包装规格: 7.7毫克/片,8片/盒
计价单位:盒
生产厂家中文参考译名:
生产厂家英文名:Arbor Pharmaceuticals, LLC
原产地英文商品名:GLIADEL WAFER IMPLANT DS 8
原产地英文药品名:CARMUSTINE IN POLIFEPROSAN 20
中文参考商品译名:Gliadel WAFER植入物 7.7毫克/片 8片/包
中文参考药品译名:卡莫司汀
曾用名:
简介:GLIADEL®WAFER(carmustine implant,中文译名卡莫司汀植入膜剂)-全球唯一治疗恶性胶质瘤新药近日,FDA批准其治疗脑癌的专利药:以聚苯丙生20为载体的卡莫司汀植入膜剂(polifeprosan 20with carmustineimplant,Gliadel)为罕用药,在治疗接受一期切除术的恶性胶质瘤患者领域享有7年的市场独占期。Gliadel为一种白色至灰白色的一角硬币大小的薄膜,包含生物可降解聚合物聚苯丙生20和7.7mg卡莫司汀(carmustine,BCNU),卡莫司汀是治疗恶性胶质瘤的常用静脉给药的化疗药物。当手术切除脑瘤时,在经手术创建的空腔中可最多植入8片本品。在植入处,Gliadel将缓慢溶解,直接向肿瘤部位释放高浓度卡莫司汀,使扩撒到其它部位的药物减至最少。Gliadel适应证是新诊断为高度恶性胶质瘤的患者的手术和放疗辅助药物,也可作为多形性胶质母细胞瘤(GBM)复发患者的手术辅助用药。批准日期:2012年12月31日,公司:ArborPharmaceuticals, LLCGLIADEL®WAFER(卡莫司汀[carmustineimplant])植入物,用于颅内使用美国初步批准:1996年
作用机制
GLIADEL晶片的活性是由于释放肿瘤切除腔中的卡莫司汀,DNA和RNA烷基化剂的细胞毒性浓度。在暴露于切除腔的水环境中,共聚物中的酸酐键被水解,将卡莫司汀,羧基苯氧基丙烷和癸二酸释放到周围的脑组织中。适用范围及用途GLIADEL晶片是一种烷基化药物
适应症
用于治疗:新诊断的高级恶性胶质瘤作为手术和放射的辅助手段和复发性胶质母细胞瘤多形性作为手术的辅助手段。
剂量和管理推荐剂量:
8毫克7.7毫克晶片(总剂量61.6毫克)植入颅内。遵循准备和处理建议。剂量形式和强度每个GLIADEL晶片含有7.7毫克卡莫司汀。
禁忌症
没有
警告和注意事项癫痫发作:
监测患者癫痫发作后的植入。颅内高血压:监测患者颅内压升高的迹象。损伤神经外科伤口愈合:监测患者开颅手术并发症。脑膜炎:监测患者细菌或化学性脑膜炎的症状。晶片移植:监测患者阻塞性脑积水的征兆。胚胎- 胎儿毒性:可引起胎儿伤害。
不良反应
新诊断的高级恶性胶质瘤:最常见的不良反应(发生率>10%,手臂差异≥4%)为脑水肿,虚弱,恶心,呕吐,便秘,伤口愈合异常和抑郁。复发性高级恶性胶质瘤:最常见的不良反应(发生率>
10%,手臂差异≥4%)为尿路感染,伤口愈合异常和发烧。
在特定人口中使用儿科用药:
安全无效。
如何提供/存储和处理
GLIADEL晶圆在单个剂量治疗盒中提供,包含八个单独包装的晶片。 每个晶片含有7.7毫克卡莫司汀,并包装在两个铝箔层压袋中。内袋是无菌的,设计用于保持产品不育,并保护产品免受潮湿。 外袋是可剥离的外包装。外袋的外表面不是无菌的。单剂量治疗盒NDC:24338-050-08将GLIADEL晶片存放在-20ºC或以下(-4ºF)。在30天的时间内,不要将未打开的铝箔袋在室温下保持六个小时以上,最多三次。GLIADEL晶片是一种细胞毒性药物,应特别处理和处置程序。
用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 卡莫司汀植入物片Gliadel WAFER 7.7mge(carmustine implant)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 卡莫司汀植入物片Gliadel WAFER 7.7mge(carmustine implant)