替莫唑胺胶囊temozolomide(Temodar Capsules 100mg)
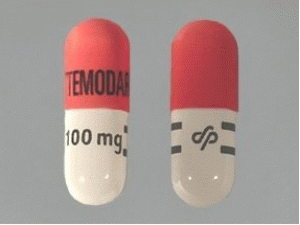 产地国家:欧洲共同体国家
产地国家:欧洲共同体国家
处方药:是
所属类别: 100毫克/胶囊 5胶囊/盒
包装规格: 100毫克/胶囊 5胶囊/盒
计价单位:盒
生产厂家英文名:SCHERING
原产地英文商品名:TEMODAL CAPSULE 100mg/cap 5caps/box
原产地英文药品名:TEMOZOLOMIDE
中文参考商品译名:TEMODAL胶囊剂 100毫克/胶囊 5胶囊/盒
中文参考药品译名:替莫唑胺
简介
抗癌药temozolomide(商品名Temodar)已被FDA批准上市,用于治疗难治性中性粒细胞性星形细胞瘤的成人患者。Temodar是美国在20年内首批的新类型的脑肿瘤的化疗药物。
批准日期:1999年8月11日
公司:先灵公司TEMODAR(替莫唑胺[temozolomide])胶囊TEMODAR(替莫唑胺[temozolomide])注射,静脉输注给予注射用
美国最初批准:1999年
最近的重大变化剂量和用法,准备和管理[02/2011]
作用机制
替莫唑胺不是直接活性的,而是在生理pH下经历快速非酶促转化为反应性化合物5-(3-甲基三嗪-1-基)- 咪唑-4-甲酰胺(MTIC)。 认为MTIC的细胞毒性主要是由于DNA的烷基化。 烷基化(甲基化)主要发生在鸟嘌呤的O6和N7位置。
适应症和用法:TEMODAR是一种烷基化药物,适用于治疗成人患者:新诊断的多形性胶质母细胞瘤(GBM)伴随放射治疗,然后作为维持治疗。在含有亚硝基脲和丙卡巴肼的药物方案中经历疾病进展的难治性间变性星形细胞瘤患者。
剂量和给药:新诊断的GBM:75mg/m 2伴随局灶放疗,随后初始维持剂量为150mg/m 2,每天一次,持续第1天至第28天的TEMODAR,持续6个周期。难治性间变性星形细胞瘤:初始剂量150mg/m 2,每天一次,连续5天,每28天治疗一次。TEMODAR在90分钟内静脉输注的推荐剂量与口服胶囊制剂的剂量相同。只有当注射TEMODAR超过90分钟时才建立生物等效性。剂量形式和强度胶囊:5毫克,20毫克,100毫克,140毫克,180毫克和250毫克。注射用粉末:100毫克。
禁忌症:已知对任何TEMODAR组分或达卡巴嗪(DTIC)的超敏反应。
警告和注意事项
(1)骨髓抑制 - 在给药前和整个治疗过程中监测绝对中性粒细胞计数(ANC)和血小板计数。老年患者和女性患骨髓抑制的风险较高。已观察到骨髓增生异常综合征和继发性恶性肿瘤,包括骨髓性白血病。
(2)所有接受TEMODAR和放射治疗的患者都需要预防卡氏肺孢子虫肺炎(PCP)-42天治疗新诊断的多形性胶质母细胞瘤的方案。
(3)应密切观察所有患者,尤其是那些接受类固醇治疗的患者,以确定淋巴细胞减少症和PCP的发生。
(4)应按规定在整个治疗过程中获得全血细胞计数。
(5)给孕妇服用时可能会发生胎儿伤害。
(6)应建议女性在接受TEMODAR时避免怀孕。
(7)由于生物等效性仅在超过90分钟时才建立,因此在较短或较长时间内输注可能导致剂量不理想;不能排除输液相关不良反应增加的可能性。
不良反应:最常见的不良反应(≥10%发生率)是:脱发,疲劳,恶心,呕吐,头痛,便秘,厌食,抽搐,皮疹,偏瘫,腹泻,虚弱,发热,头晕,协调异常,病毒感染,健忘症和失眠。在使用替莫唑胺治疗期间发生的最常见的3至4级血液学实验室异常(≥10%发生率)是:淋巴细胞减少,血小板减少,中性粒细胞减少和白细胞减少。还报道了过敏反应。
药物相互作用:丙戊酸:降低替莫唑胺的口服清除率。
用于特定人群:(1)哺乳母亲,不推荐。(2)儿科用药:没有确定的用途。(3)肝/肾功能损害:对患有严重肾或肝功能损害的患者进行TEMODAR治疗时应谨慎行事。
存储:将TEMODAR胶囊储存在25°C(77°F);允许的偏差为15°-30°C(59°-86°F)[见USP受控室温]。将TEMODAR for Injection冷冻保存在2°-8°C(36°-46°F)。重构后,将重构产物在室温(25°C [77°F])下储存。重组产品必须在14小时内使用,包括输注时间。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 替莫唑胺胶囊temozolomide(Temodar Capsules 100mg)