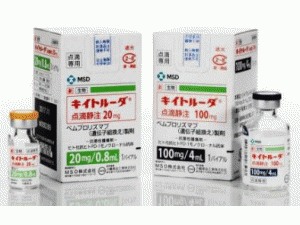
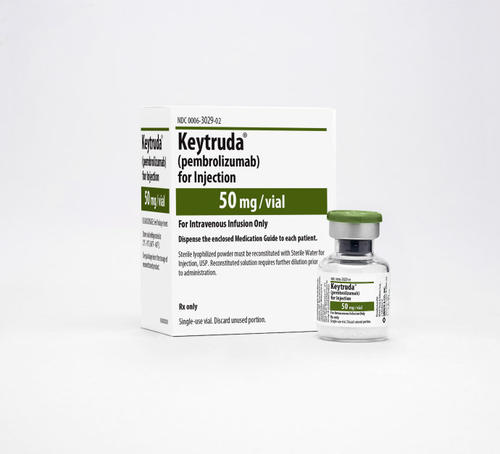
派姆单抗冻干粉注射剂(Keytruda 25mg/ml 4nl vial)
 产地国家:美国
处方药:是
所属类别: 25毫克/毫升 4毫升/瓶
包装规格: 25毫克/毫升 4毫升/瓶
计价单位:瓶
生产厂家英文名:MERCK SHARP & DOHME CORP
原产地英文商品名:KEYTRUDA 25MG/ML 4ML SDV 1/EA
原产地英文药品名:PEMBROLIZUMAB
中文参考商品译名:KEYTRUDA冻干粉注射剂 25毫克/毫升 4毫升/瓶
中文参考药品译名:派姆单抗
产地国家:美国
处方药:是
所属类别: 25毫克/毫升 4毫升/瓶
包装规格: 25毫克/毫升 4毫升/瓶
计价单位:瓶
生产厂家英文名:MERCK SHARP & DOHME CORP
原产地英文商品名:KEYTRUDA 25MG/ML 4ML SDV 1/EA
原产地英文药品名:PEMBROLIZUMAB
中文参考商品译名:KEYTRUDA冻干粉注射剂 25毫克/毫升 4毫升/瓶
中文参考药品译名:派姆单抗
简介:
默克首创PD-1抑制剂pembrolizumab(商品名 Keytruda®)获FDA批准扩展用于治疗古典霍奇金淋巴瘤(cHL)患者批准日期:2014年9月4日;公司:Merck & Co.,IncKEYTRUDA(派姆单抗[pembrolizumab])注射,用于静脉注射KEYTRUDA(派姆单抗[pembrolizumab])注射,注射用于静脉注射美国初步批准:2014年最近的主要变化适应症和用法:05/2017剂量和管理:07/2017 作用机制:将PD-1配体,PD-L1和PD-L2与T细胞上发现的PD-1受体的结合抑制T细胞增殖和细胞因子产生。 PD-1配体的上调发生在一些肿瘤中,并且通过该途径的信号传导可以有助于抑制肿瘤的活性T细胞免疫监视。 Pembrolizumab是与PD-1受体结合并阻断其与PD-L1和PD-L2的相互作用的单克隆抗体,释放PD-1途径介导的免疫应答的抑制,包括抗肿瘤免疫应答。在同基因小鼠肿瘤模型中,阻断PD-1活性导致肿瘤生长减少。 适应症:KEYTRUDA是一种程序性死亡受体-1(PD-1)阻断抗体,如下所示:黑色素瘤用于治疗不可切除或转移性黑素瘤的患者。非小细胞肺癌(NSCLC)作为用于一线治疗转移性NSCLC患者的单一药物,其肿瘤具有高PD-L1表达[(肿瘤比例评分(TPS)≥50%)],通过FDA批准的测试确定,无EGFR或ALK基因组肿瘤畸变。作为用于治疗转移性NSCLC患者的单一药剂,其肿瘤表达通过FDA批准的测试确定的PD-L1(TPS≥1%),在含铂化疗后或之后发生疾病进展。 患有EGFR或ALK基因组肿瘤畸变的患者在接受KEYTRUDA之前,应在FDA批准的这些畸变治疗中具有疾病进展。 与培美曲塞和卡铂组合,作为转移性非鳞癌NSCLC患者的一线治疗。该指征基于肿瘤反应率和无进展生存期的加速批准获得批准。继续批准该指征可能取决于确认试验中临床获益的验证和描述。 头颈部鳞状细胞癌(HNSCC)用于治疗复发性或转移性HNSCC患者,在含铂化疗后,进行疾病进展。该指征根据肿瘤反应率和反应耐久性加快批准。继续批准该指征可能取决于确认试验中临床获益的验证和描述。 古典霍奇金淋巴瘤(cHL)用于治疗患有难治性cHL的成人和儿科患者,或者在3次或更多次治疗之后复发。该指征根据肿瘤反应率和反应耐久性加快批准。继续批准该指征可能取决于确认试验中临床获益的验证和描述。 尿路上皮癌用于治疗不符合顺铂化疗的局部晚期或转移性尿路上皮癌患者。该指征根据肿瘤反应率和反应持续时间加快批准。继续批准该指征可能取决于确认试验中临床获益的验证和描述。 用于治疗在含铂化疗期间或之后具有疾病进展的局部晚期或转移性尿路上皮癌患者,或在含铂化疗的新辅助或辅助治疗的12个月内治疗。 微卫星不稳定性 - 高癌症用于治疗成人和儿科患者 存储:在2°C至8°C(36°F至46°F)的冷藏条件下储存小瓶。防止光照。 不要冻结 不要动摇。用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 派姆单抗冻干粉注射剂(Keytruda 25mg/ml 4nl vial)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 派姆单抗冻干粉注射剂(Keytruda 25mg/ml 4nl vial)