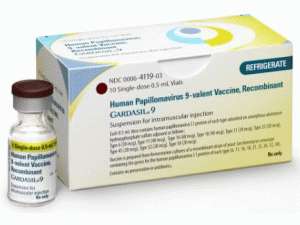
乳头瘤病毒9价疫苗,重组注射悬浮液(Gardasil 9 SDV 10X0.5ml)
 产地国家:美国
处方药:是
所属类别: 10瓶X0.5毫升
包装规格: 10瓶X0.5毫升
计价单位:盒
生产厂家英文名:MERCK & CO/USHH PDP
原产地英文商品名:GARDASIL 9 SDV 10X0.5ML
原产地英文药品名:HPV VACCINE 9-VALENT/PF
中文参考商品译名:GARDASIL注射悬浮液 10瓶X0.5毫升
中文参考药品译名:人乳头瘤病毒9价疫苗,重组
产地国家:美国
处方药:是
所属类别: 10瓶X0.5毫升
包装规格: 10瓶X0.5毫升
计价单位:盒
生产厂家英文名:MERCK & CO/USHH PDP
原产地英文商品名:GARDASIL 9 SDV 10X0.5ML
原产地英文药品名:HPV VACCINE 9-VALENT/PF
中文参考商品译名:GARDASIL注射悬浮液 10瓶X0.5毫升
中文参考药品译名:人乳头瘤病毒9价疫苗,重组
简介:
近日,美国食品和药物管理局(FDA)已批准HPV疫苗Gardasil 9(Human Papillomavirus 9-valent Vaccine, Recombinant)的补充生物制品许可(sBLA),扩大该疫苗的适龄人群,用于27-45岁的男性和女性群体,预防由疫苗Gardasil 9所涵盖的9种HPV类型所引起的某些癌症和疾病。之前,FDA已授予该sBLA优先审查资格。此前,在美国市场,Gardasil 9的适龄人群为9-26岁的男性和女性群体,具体为:Gardasil 9适用于9-26岁的女性,预防7种高危型HPV(16、18、31、33、45、52、58)引起的宫颈、外阴、阴道、肛门癌症,预防有2种低危型HPV(6、11)引起的生殖器疣;Gardasil 9也适用于9-26岁的男性,预防7种高危型HPV(16、18、31、33、45、52、58)引起的肛门癌,预防由2种低危型HPV(6、11)引起的生殖器疣,预防由9种HPV(6、11、16、18、31、33、45、52、58)引起的癌前病变或异常增生病变。批准日期:2018年10月6日 公司:默沙东GARDASIL 9(人乳头瘤病毒9价疫苗,重组[Human Papillomavirus 9-valent Vaccine, Recombinant])注射,用于肌内注射的悬浮液美国最初批准:2014年最近的重大变化适应症和用法:10/2018用法用量:10/2018 作用机制:HPV只感染人类。使用类似动物乳头瘤病毒的动物研究表明,L1VL P疫苗的功效可能涉及体液免疫应答的发展。GARDASIL 9对抗与人类疫苗相关的肛门生殖器疾病的功效被认为是由疫苗诱导的体液免疫应答介导的,尽管确切的保护机制尚不清楚。 适应症和用法:GARDASIL 9是一种疫苗,(1)适用于9至45岁的女孩和女性,用于预防以下疾病:由HumanPapillomavirus(HPV)类型16,18,31,33,45,52和58引起的宫颈癌,外阴癌,阴道癌和肛门癌。生殖器疣(尖锐湿疣)由HPV 6型和11型引起。以及由HPV类型6,11,16,18,31,33,45,52和58引起的以下癌前病变或发育不良病变:宫颈上皮内瘤变(CIN)2/3级和原位宫颈腺癌(AIS)。宫颈上皮内瘤变(CIN)1级。外阴上皮内瘤变(VIN)2级和3级。阴道上皮内瘤变(VaIN)2级和3级。肛门上皮内瘤变(AIN)1级,2级和3级。(2)GARDASIL 9适用于9至45岁的男孩和男孩,用于预防以下疾病:由HPV类型16,18,31,33,45,52和58引起的肛门癌。生殖器疣(尖锐湿疣)由HPV 6型和11型引起。以及由HPV类型6,11,16,18,31,33,45,52和58引起的以下癌前病变或发育不良病变:肛门上皮内瘤变(AIN)1级,2级和3级。 使用限制和有效性:GARDASIL 9并未消除女性继续接受推荐的宫颈癌筛查的必要性。如果医疗保健提供者建议,GARDASIL 9的接受者不应停止肛门癌的筛查。GARDASIL 9尚未被证明能够提供针对一个人之前通过性活动暴露的疫苗HPV类型的疾病的保护。GARDASIL 9尚未被证明可以预防由于6,11,16,18,31,33,45,52和58以外的HPV类型引起的疾病。GARDASIL 9不是外生殖器病变的治疗方法;宫颈癌,外阴癌,阴道癌和肛门癌; CIN; VIN;徒然的。或者AIN。并非所有外阴,阴道和肛门癌均由HPV引起,而GARDASIL 9仅保护HPV16,18,31,33,45,52和58引起的外阴,阴道和分析物。GARDASIL 9不能预防不是由HPV引起的生殖器疾病。用GARDASIL 9疫苗接种可能不会对所有疫苗接种者产生保护作用。 剂量和给药:仅用于肌肉注射。GARDASIL 9的每剂量为0.5-mL管理GARDASIL 9如下:年龄 注射 时间表9到14年 2剂量 0,6至12个月 3剂量 0,2,6个月15至45年 3剂量 0,2,6个月如果第二剂量在第一剂量后5个月之前给药,则在第二剂量后至少4个月给予第三剂量。 剂量形式和强度:注射用0.5-mL悬浮液作为单剂量小瓶和预填充注射器。 禁忌症:过敏,包括对酵母(疫苗成分)的严重过敏反应,或先前剂量的GARDASIL 9或GARDASIL®后。 警告和注意事项:由于疫苗接种者可能会出现晕厥,有时会导致受伤,因此建议在给药后观察15分钟。在HPV疫苗接种后,已报道晕厥,有时与强直 - 阵挛性运动和其他类似癫痫样活动有关。当晕厥与强直 - 阵挛相关时运动,活动通常是短暂的,通常通过保持仰卧或特伦德伦堡位置来恢复脑灌注。 不良反应:最常见(≥10%)局部和全身不良反应报告:在16至26岁的女孩和女性中:注射部位疼痛(89.9%),注射部位肿胀(40.0%),注射部位红斑(34.0%)和头痛(14.6%)。在9至15岁的女孩中:注射部位疼痛(89.3%),注射部位肿胀(47.8%),注射部位红斑(34.1%)和头痛(11.4%)。在16至26岁的男孩和男人中:注射部位疼痛(63.4%),注射部位肿胀(20.2%)和注射部位红斑(20.7%)。在9至15岁的男孩中:注射部位疼痛(71.5%),注射部位肿胀(26.9%)和注射部位红斑(24.9%)。 包装提供/存储和处理:(1)GARDASIL 9以小瓶和注射器供应。纸盒中的10个0.5mL单剂量小瓶。 NDC 0006-4119-03纸盒由10个0.5mL单剂量预装Luer Lock注射器组成,带尖端帽。NDC 0006-4121-02冷藏至2至8°C(36至46°F)。不要冻结。 避光。(2)GARDASIL 9应在从冷藏中取出后尽快给药。GARDASIL 9可以在冷藏(温度在8°C和25°C之间)的总时间(累计多次偏移)时间不超过72小时的情况下给药。 只要0°C和2°C之间的总时间不超过72小时,也允许0°C和2°C之间的累积多次偏移。用药温馨提示:当您服用此药物时,需定期接受医疗专业人士的检查,以便随时针对其药效、副作用等情况进行监测。本网站所包含的信息旨在为患者提供帮助,不能代替医学建议和治疗。
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 乳头瘤病毒9价疫苗,重组注射悬浮液(Gardasil 9 SDV 10X0.5ml)
药品价格查询,专业药品查询网站,药品说明书查询,药品比价 » 乳头瘤病毒9价疫苗,重组注射悬浮液(Gardasil 9 SDV 10X0.5ml)